- 医薬品に共通する特性と基本的な知識
- 2.医薬品概論
- 医薬品概論
- Sec.1
1医薬品概論
■医薬品の本質
医薬品は、多くの場合、人体に取り込まれて作用し、効果を発現させるものである。しかし、本来、医薬品も人体にとっては異物(外来物)であるため、また、医薬品が人体に及ぼす作用は複雑、かつ、多岐に渡り、そのすべてが解明されていないため、必ずしも期待される有益な効果(薬効)のみをもたらすとは限らず、好ましくない反応(副作用)を生じる場合もある。
人体に対して使用されない医薬品についても、例えば、殺虫剤の中には誤って人体がそれに曝(さら)されれば健康を害するおそれがあるものもあり、検査薬は検査結果について正しい解釈や判断がなされなければ医療機関を受診して適切な治療を受ける機会を失うおそれがあるなど、人の健康に影響を与えるものである。
医薬品は、人の疾病の診断、治療若しくは予防に使用されること、又は人の身体の構造や機能に影響を及ぼすことを目的とする生命関連製品であり、その有用性が認められたものであるが、使用には、このような保健衛生上のリスクを伴うものであることに注意が必要である。このことは、医療用医薬品と比較すればリスクは相対的に低いと考えられる一般用医薬品であっても同様であり、科学的な根拠に基づく適切な理解や判断によって適正な使用が図られる必要がある。
|
|
要指導医薬品及び一般用医薬品 |
|
|||||
|
|
リスク区分 |
|
対応する専門家 |
|
販売者から 購入者への説明 |
|
|
|
|
要指導医薬品 |
|
薬剤師 |
|
対面で書面での情報提供及び薬学的知見に基づく指導(義務) |
|
|
|
|
一般用医薬品 |
第一類医薬品 |
|
薬剤師 |
|
書面での情報提供(義務) |
|
|
|
第二類医薬品 |
|
薬剤師または 登録販売者 |
|
努力義務 |
|
|
|
|
第三類医薬品 |
|
薬剤師または 登録販売者 |
|
法律上の規定なし |
|
|
|
|
|
|
|
|
|
|
|
医薬品は、効能効果、用法用量、副作用等の必要な情報が適切に伝達されることを通じて、購入者が適切に使用することにより、初めてその役割を十分に発揮するものであり、そうした情報を伴わなければ、単なる薬物に過ぎない。このため、一般用医薬品には、製品に添付されている文書(添付文書)や製品表示に必要な情報が記載されている。
一般用医薬品は、一般の生活者が自ら選択し、使用するものであるが、一般の生活者においては、添付文書や製品表示に記載された内容を見ただけでは、効能効果や副作用等について誤解や認識不足を生じることもある。購入者が、一般用医薬品を適切に選択し、適正に使用するためには、その販売に専門家が関与し、専門用語を分かりやすい表現で伝えるなどの適切な情報提供を行い、また、購入者が知りたい情報を十分に得ることができるように、相談に対応することが不可欠である。
また、医薬品は、市販後にも、医学・薬学等の新たな知見、使用成績等に基づき、その有効性、安全性等の確認が行われる仕組みになっており、それらの結果を踏まえ、リスク区分の見直し、承認基準の見直し等がなされ、販売時の取扱い、製品の成分分量、効能効果、用法用量、使用上の注意等が変更となった場合には、それが添付文書や製品表示の記載に反映されている。
医薬品は、このように知見の積み重ねによって、有効性、安全性等に関する情報が集積されており、随時新たな情報が付加されるものである。一般用医薬品の販売に従事する専門家においては、これらに円滑に対応できるよう常に新しい情報の把握に努める必要がある。
このほか、医薬品は、人の生命や健康に密接に関連するものであるため、高い水準で均一な品質が保証されていなければならない。医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和35年法律第145号。以下「法」という。)では、健康被害の発生の可能性の有無にかかわらず、異物等の混入、変質等があってはならない旨を定めており、医薬品の販売等を行う者においても、そのようなことがないよう注意するとともに、製造販売業者による製品回収等の措置がなされることもあるので、製造販売業者等からの情報に日頃から留意しておくことが重要である。
■医薬品のリスク評価
医薬品は、使用方法を誤ると健康被害を生じることがある。医薬品の効果とリスクは、薬物曝露時間と曝露量との積で表現される用量-反応関係に基づいて評価される。
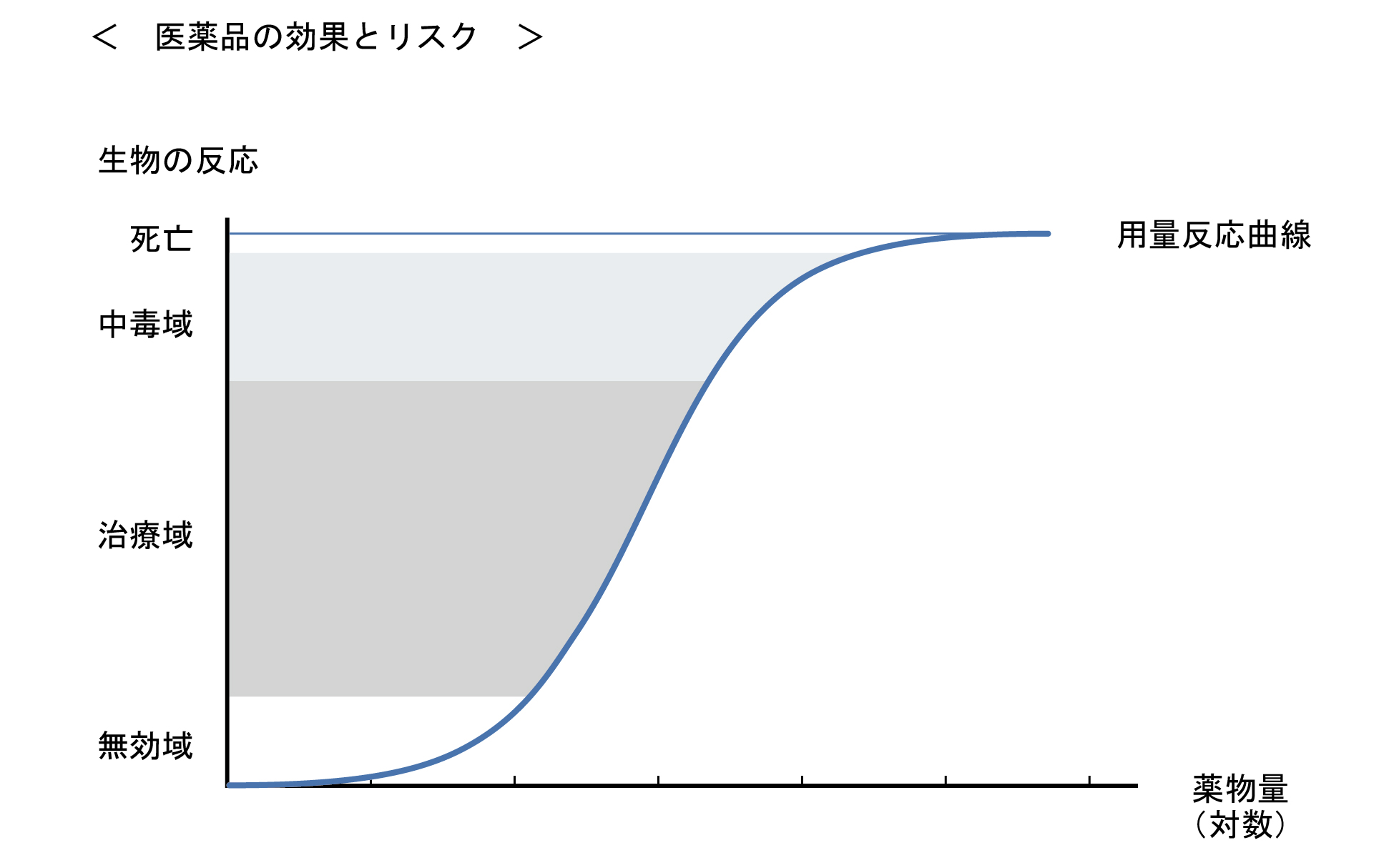
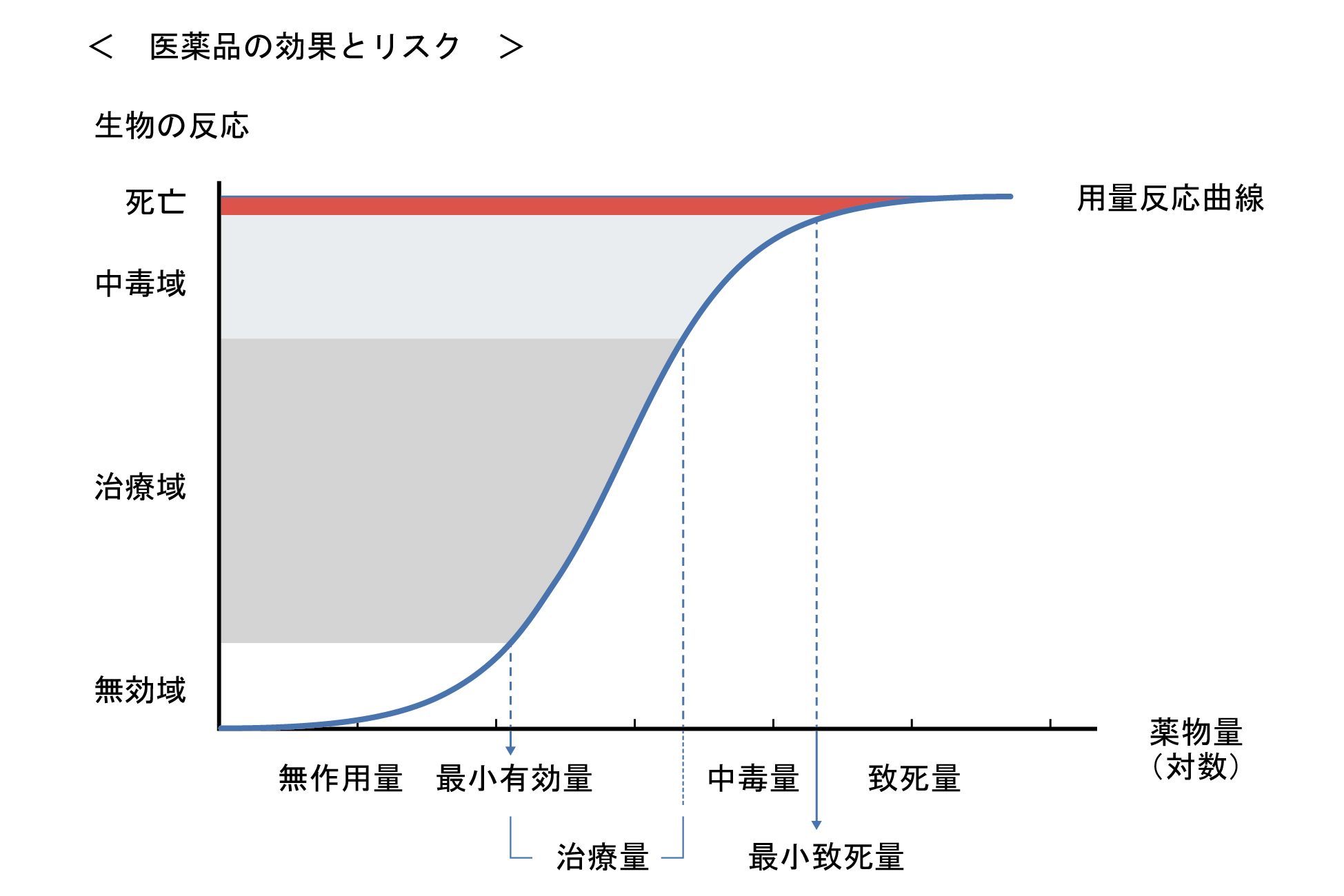
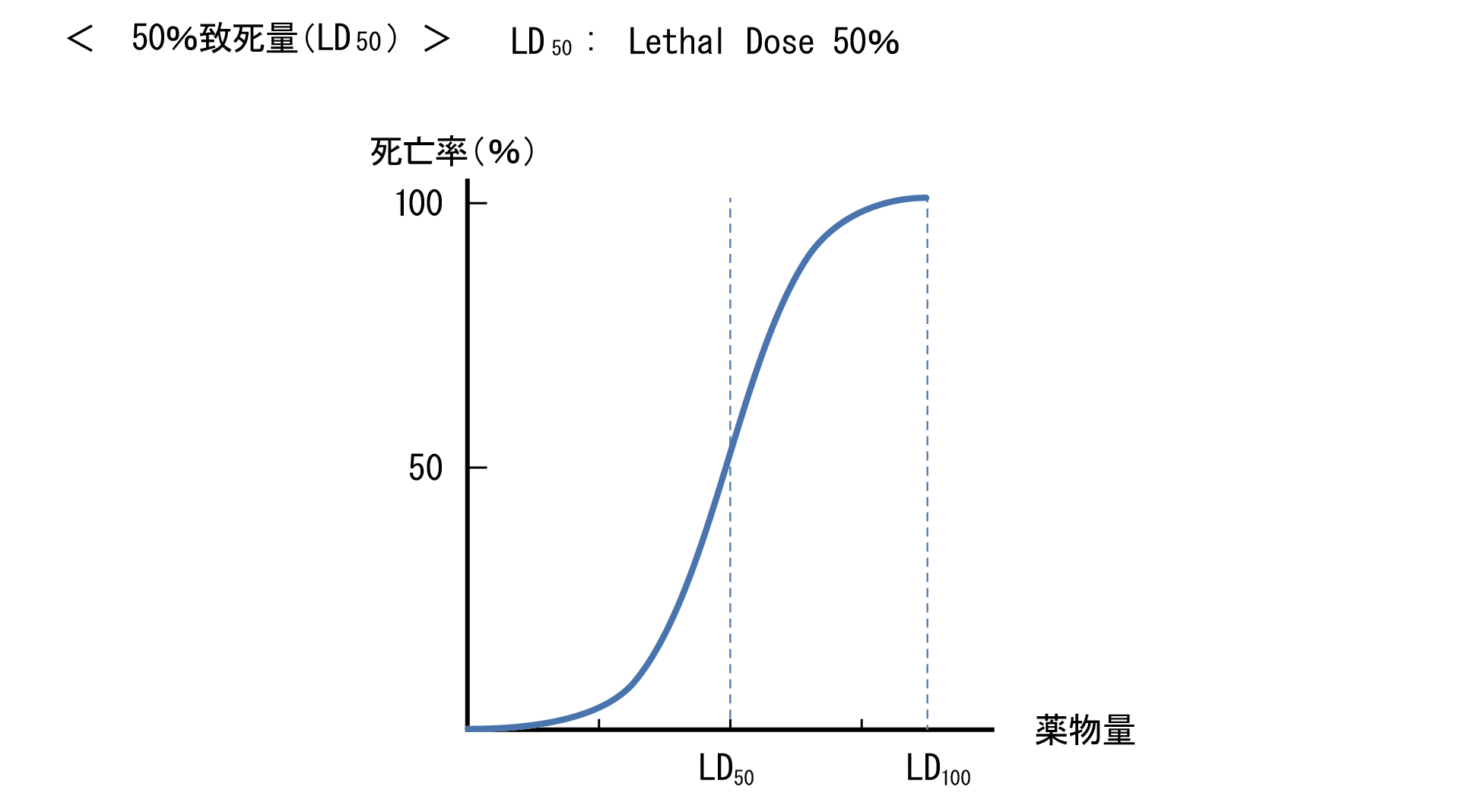
投与量と効果又は毒性の関係は、薬物用量を増加させるに伴い、効果の発現が検出されない「無作用量」から、最小有効量を経て「治療量」に至る。治療量上限を超えると、効果よりも有害反応が強く発現する「中毒量」となり、「最小致死量」を経て、「致死量」に至る。動物実験により求められる50%致死量(LD50)は、薬物の毒性の指標として用いられる。
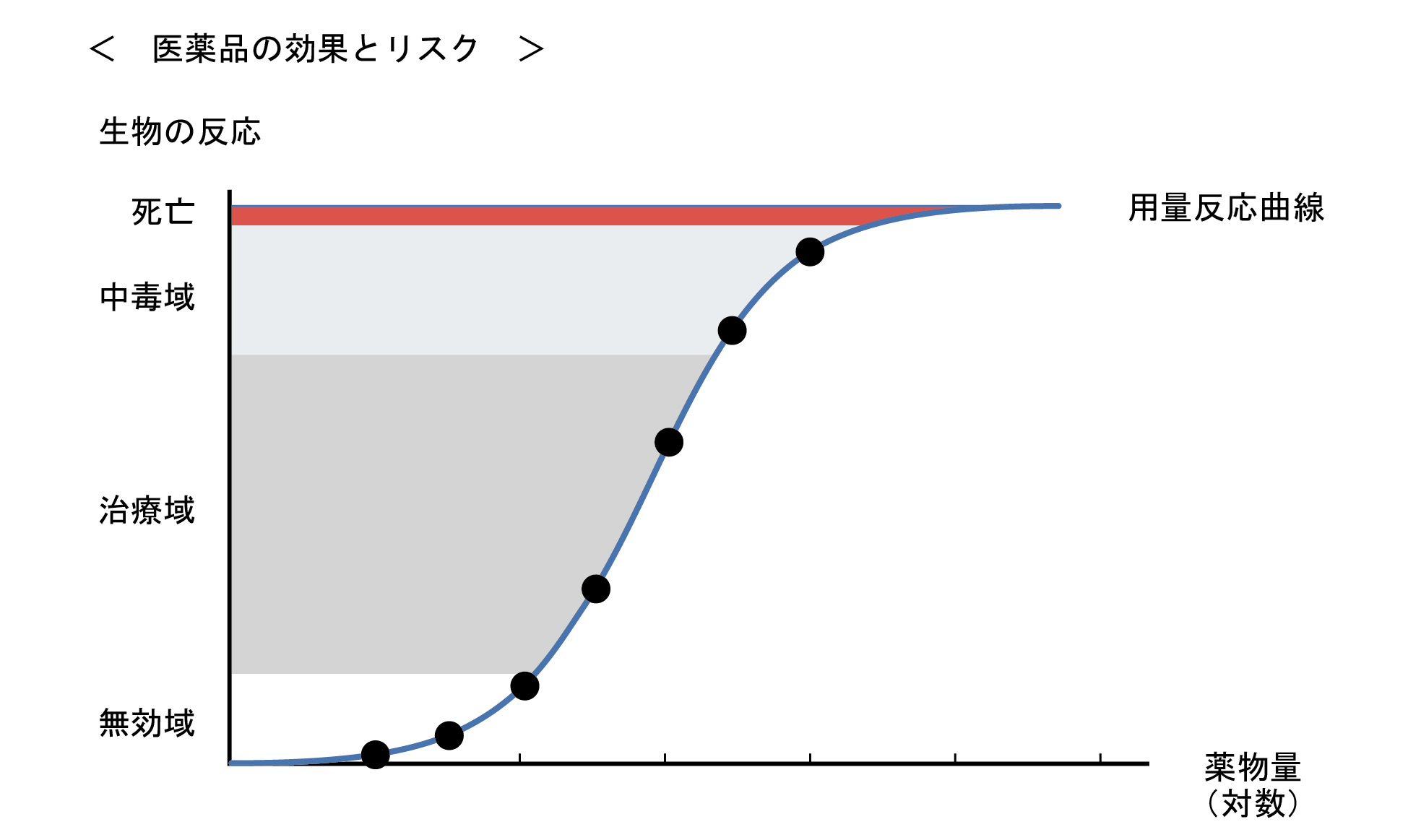
治療量を超えた量を単回投与した後に毒性が発現するおそれが高いことは当然であるが、少量の投与でも長期投与されれば慢性的な毒性が発現する場合もある。また、少量の医薬品の投与でも発がん作用、胎児毒性や組織・臓器の機能不全を生じる場合もある。このような考えから、新規に開発される医薬品のリスク評価は、医薬品開発の国際的な標準化(ハーモナイゼーション)制定の流れのなかで、個々の医薬品の用量-反応関係に基づいて、医薬品の安全性に関する非臨床試験の基準である Good Laboratory Practice(GLP)に準拠して薬効-薬理試験や一般薬理作用試験の他に、医薬品毒性試験法ガイドラインに沿って、単回投与毒性試験、反復投与毒性試験、生殖・発生毒性試験、遺伝毒性試験、がん原性試験、依存性試験、抗原性試験、局所刺激性試験、皮膚感作性試験、皮膚光感作性試験などの毒性試験が厳格に実施されている。
動物実験で医薬品の安全性が確認されると、ヒトを対象とした臨床試験が行われる。ヒトを対象とした臨床試験における効果と安全性の評価基準には、国際的に Good Clinical Practice (GCP)が制定されており、これに準拠した手順で安全な治療量を設定することが新規医薬品の開発に関連する臨床試験(治験)の目標の一つである。
さらに、医薬品に対しては製造販売後の調査及び試験の実施基準として Good Post-marketing Study Practice (GPSP) と製造販売後安全管理基準として Good Vigilance Practice (GVP)が制定されている。このように、医薬品については、食品などよりもはるかに厳しい安全性基準が要求されているのである。
■健康食品
「薬(医)食同源」という言葉があるように、古くから特定の食品摂取と健康増進との関連は関心を持たれてきた。健康増進や維持の助けとなる食品は一般的に「健康食品」として呼ばれ、広く使用されている。食品は、法で定める医薬品とは異なり、身体構造や機能に影響する効果を表示することはできないが、例外的に特定保健用食品については、「特定の保健機能の表示」、例えばキシリトールを含む食品に対して「虫歯の原因になりにくい食品です」などの表示が許可されており、「栄養機能食品」については、各種ビタミン、ミネラルに対して「栄養機能の表示」ができる。((第4章Ⅱ-3)【保健機能食品等の食品】参照。)
近年、セルフメディケーションへの関心が高まるとともに、健康補助食品(いわゆるサプリメント)などが健康推進・増進を目的として広く国民に使用されるようになった。それらの中にはカプセル、錠剤等の医薬品と類似した形状で発売されているものも多く、誤った使用法により健康被害を生じた例も報告されている。医薬品を扱う者は、いわゆる健康食品は法的にも、また安全性や効果を担保する科学的データの面でも医薬品とは異なるものであることを認識し、消費者に指導・説明を行わなくてはならない。
また、平成27年4月より「機能性表示食品」制度が施行された。「機能性表示食品」は、疾病に罹(り)患していない者の健康の維持及び増進に役立つ旨又は適する旨(疾病リスクの低減に係るものを除く。)を表示するものである。